На приеме я всегда подробно объясняю своим пациенткам, что такое овуляция или ЭКО в естественном цикле. Так вот, хочу начать серию публикаций, где буду развернуто давать определение различным понятиям, а также приводить примеры из практики или научных исследований. Доступным языком. Считаю это необходимым для будущих мамочек, чтобы сформировалась целостная картина относительно понятия репродуктивного здоровья. Своего или своей дочери. По алфавиту начнем с АМГ.
Антимюллеров гормон (АМГ) относится к факторам роста и получил свое название из-за роли в формировании мужского пола в эмбриональном периоде. Из мюллеровых протоков — первоначальных зачатков женской половой системы — у девочек образуются матка, маточные трубы и верхняя часть влагалища. Если это мальчик, то на 5-6 неделе внутриутробного развития в яичках начинает вырабатываться АМГ и мюллеровы протоки рассасываются. Отсюда и название гормона. Происходит это потому, что изначально мы все женского пола. АМГ у мальчиков растет вплоть до начала полового созревания, а затем резко падает до минимума и в половых железах начинает вырабатываться тестостерон. АМГ образуется также у девочек и женщин в яичниках, в маленьких растущих фолликулах размером до 8 мм. Фолликулы — это «домики» для яйцеклеток. С помощью АМГ врачи оценивают функцию яичников. Рост фолликулов достаточно долгий, начиная с пубертатного периода, занимает примерно 3-4 месяца от самой ранней стадии («спящих» фолликулов) до завершающей стадии, когда размер фолликула достигает 18-20мм (при таком размере происходит овуляция, т. е. фолликул лопается и яйцеклетка «выходит в открытое плавание» для встречи со сперматозоидом). Первая стадия самая длительная, гормонально-независимая, то есть нет влияния центральных гормонов - фолликулостимулирующего и лютеинизирующего (ФСГ и ЛГ). В определенный момент развития ФСГ начинает оказывать воздействие на дальнейший рост, при этом АМГ постепенно перестает вырабатываться.
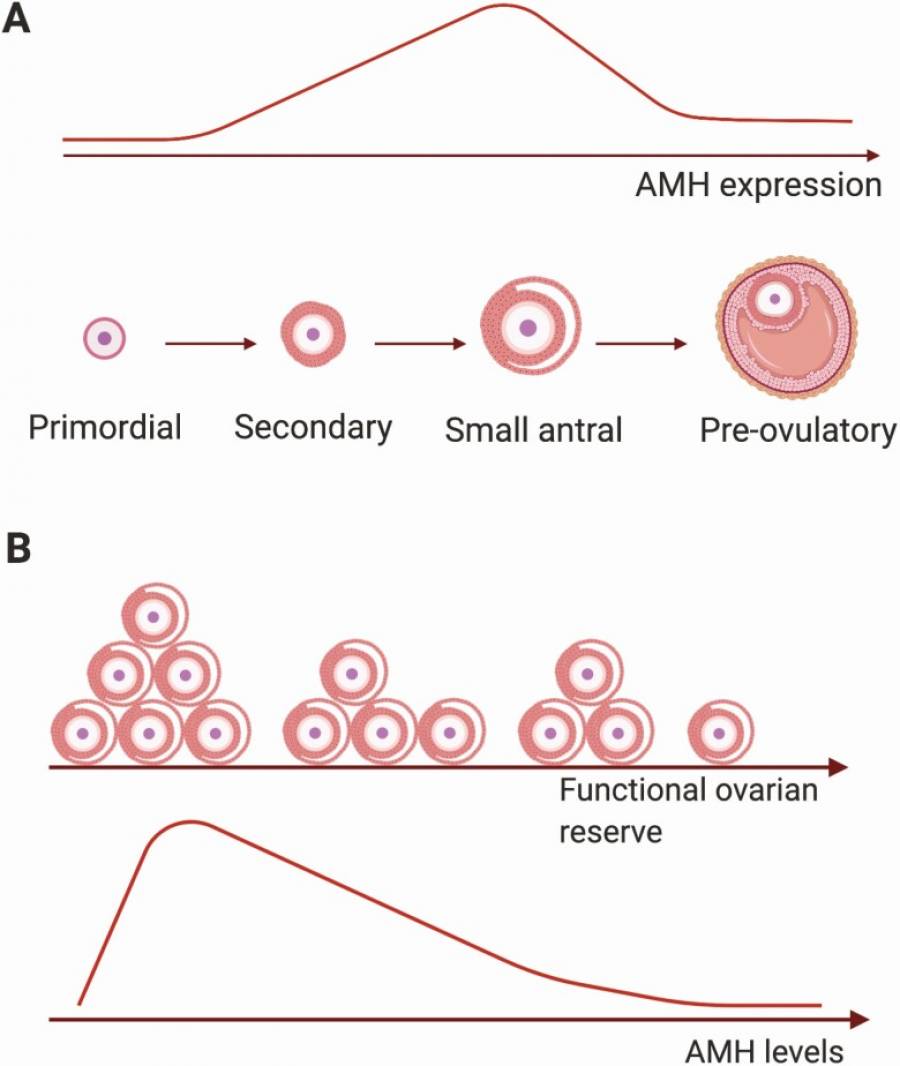
Количество и качество «спящих» фолликулов, то есть тех, которые еще не вступили в активный рост, определяют яичниковый или овариальный резерв. Поскольку не существует показателя, который бы мог напрямую измерить количество «спящих» фолликулов, АМГ в настоящее время является лучшим показателем овариального резерва, так как косвенно отражает количество растущих фолликулов (1). Первые исследования, проведенные почти двадцать лет назад, подтвердили, что уровень АМГ в крови действительно сильно зависит от количества растущих фолликулов, и что оба показателя снижаются с возрастом (2). На основании этих выводов сывороточный АМГ был признан в качестве косвенного маркера овариального резерва, несмотря на ограниченные знания о факторах, которые влияют на его образование в яичниках, и отсутствие стандартизированных методов анализа АМГ. Возникла путаница или даже неправильное толкование термина «овариальный резерв». Чтобы провести четкое различие между запасом «спящих» фолликулов и запасом растущих фолликулов, был предложен термин «функциональный овариальный резерв» (ФОР) (3). ФОР представляет собой запас фолликулов диаметром от 2 до 5 мм, из которых 1 фолликул под влиянием ФСГ должен овулировать (лопнуть при достижении 18-20 мм). Таким образом, уровень АМГ в крови напрямую отражает ФОР (рис. Б). На картинке к статье:
(А) Выработка АМГ в яичниках увеличивается от вторичной стадии (без полости) до стадии малого полостного фолликула. В преовуляторных фолликулах АМГ выделяется только в клетках гранулезного кумулята, окружающих ооцит (темно-розовый слой). (Б) С возрастом функциональный резерв яичников снижается в результате истощения пула «спящих» фолликулов. Это приводит к уменьшению количества мелких полостных фолликулов и, как следствие, к снижению уровня АМГ в крови, достигая неопределяемых уровней в период менопаузы. (источник: Jeppesen JV, Anderson RA, Kelsey TW, et al. Which follicles make the most anti-mullerian hormone in humans? Evidence for an abrupt decline in AMH production at the time of follicle selection. Mol Hum Reprod. 2013;19(8):519-527).
Примечательно, что только в старшем репродуктивном возрасте (после 35 лет) АМГ отражают количество «спящих» фолликулов, тогда как в молодом возрасте уровни АМГ в крови коррелируют с количеством растущих фолликулов (4). Подобные результаты описаны в исследованиях, в которых плотность «спящих» и малых растущих фолликулов определялась в яичниках, удаленных по гинекологическим показаниям (доброкачественные заболевания). У женщин младше 35 лет уровни АМГ не коррелировали, тогда как у женщин позднего репродуктивного возраста наблюдалась значительная связь с плотностью «спящих» фолликулов (5-8). Эти исследования показывают, что уровни АМГ в крови женщин всех возрастов отражают ФОР, и только в старшем репродуктивном возрасте уровни АМГ могут также отражать общий запас фолликулов (овариальный резерв). Далее в статье я буду использовать понятие «функциональный овариальный резерв», когда буду упоминать АМГ.
Начиная с рождения, уровень АМГ повышаются до плато примерно к 25 годам (9,10). Эта положительная связь может отражать повышенную скорость перехода «спящих» фолликулов в растущие, наблюдаемую от рождения примерно до 14 лет (11). После 25 лет, уровень АМГ начинает постепенно снижаться до неопределяемых значений в период менопаузы, и только с этого возраста можно наблюдать отрицательную корреляцию между уровнем АМГ и возрастом (9,10). Однако, в любом возрасте существуют значительные различия в показателях АМГ (12-14). Аналогично тому, что выявляется при подсчете растущих полостных фолликулов, существуют большие индивидуальные различия в уровнях АМГ (15,16). Этническая принадлежность может способствовать этим различиям, и ее следует учитывать при интерпретации значений АМГ. Хотя пиковые уровни АМГ в возрасте 25 лет были выше у китаянок по сравнению с европейскими женщинами, возрастное снижение у китаянок было более значительным, что привело к снижению уровней АМГ на 28% и 80% в возрасте 30 и 45 лет соответственно (17). Кроме того, у афроамериканских женщин наблюдались более низкие уровни АМГ в сыворотке крови по сравнению с белыми женщинами, но с более медленным возрастным снижением (18,19).
АМГ обычно измеряется в первой фазе цикла, как и другие гормоны: ФСГ, эстрадиол, ЛГ и др. Однако возникает вопрос, как объяснить изменения уровня АМГ во время менструального цикла? Первоначальные исследования показали, что уровни АМГ относительно стабильны в течение менструального цикла (20), более поздние исследования доказывают, что уровень АМГ значительно колеблется в течение одного цикла до 20,7% (21-23). Хотя количество женщин, участвовавших в этих исследованиях, было небольшим, четкой закономерности на протяжении менструального цикла, как для ФСГ или эстрадиола, не наблюдалось. Скорее всего, вариации уровней АМГ отражают вариации количества растущих фолликулов во время одного менструального цикла, согласно исследованию Овербека и др. (24). В его работе также было показано, что женщины с более высокими базальными уровнями АМГ, в основном молодые женщины, имели относительно более высокие колебания АМГ в течение менструального цикла. Кроме того, другие исследования подтвердили, что уровень АМГ в разных циклах может колебаться от 28% до 163%, в зависимости от используемого метода исследования АМГ (23,25). Индивидуальные вариации позволяют предположить, что однократное измерение АМГ может привести к неточной оценке функционального овариального резерва и может быть неправильно интерпретровано врачом перед выбором протокола стимуляции яичников.
Клиническая важность измерения АМГ привела к разработке нескольких лабораторных тестов АМГ. В настоящее время часто используемые ручные анализы включают модифицированный анализ Gen II (Beckman Coulter), а также сверхчувствительный иммуноферментный анализ АМГ (ELISA) и пикоАМГ-анализ (оба Ansh Labs). ПикоАМГ-ИФА имеет улучшенную чувствительность в нижнем диапазоне, что приводит к пределу обнаружения 1,3 пг/мл по сравнению с 0,08 нг/мл. Эта разница в чувствительности может иметь клиническое значение при оценке уровня АМГ в сыворотке крови, особенно в случаях, когда подозревается низкий овариальный резерв. Кроме того, в настоящее время доступны два автоматизированных анализа: Access AMH (Beckman Coulter) и Elecsys AMH (Roche). В нашем госпитале MD GROUP используется полностью автоматизированный иммунохемилюминесцентный анализатор. Разработка автоматизированных анализов повысила точность, воспроизводимость и скорость измерений и, следовательно, превосходит ручные анализы. Хотя влияние этого изменения на абсолютные значения АМГ может показаться не таким уж большим, эти колебания повлияют на пороговые значения АМГ и, следовательно, на принятие клинических решений по лечению бесплодия. Отсутствие международного стандарта АМГ, даже спустя 20 лет после разработки первого иммуноферментного анализа АМГ, является одной из основных проблем, затрудняющих сравнение разных тестов АМГ. Отсутствие единообразно откалиброванных анализов ограничивает разработку стандартизированных пороговых значений АМГ, необходимых для верной «расшифровки» врачами.
Для правильной интерпретации уровней АМГ решающее значение имеет знание факторов, влияющих на уровни АМГ. Большинство женщин принимают гормональные контрацептивы (ГК), однако сведения о влиянии ГК на уровень АМГ в крови противоречивы. Систематический обзор, проведенный Amer и соавт. (26), с включением 15 исследований, показал, что уровни АМГ в сыворотке крови у женщин снижались при использовании ГК в течение как минимум года, и этот эффект был в большинстве исследований обратимым после прекращения использования ГК. Степень снижения колебалась от 14% до 55%, что можно объяснить различиями в типе принимаемых ГК, продолжительности их использования, днем измерения АМГ (день менструального цикла) и используемых тестов АМГ. Landersoe и соавт. (27) показали, что уровни АМГ в сыворотке крови были на 30–40 % ниже у женщин, принимающих ГК или таблетки, содержащие только прогестерон, тогда как у женщин, использующих внутриматочную спираль, снижение было лишь на 17%. Кроме того, в обоих исследованиях сообщалось о снижении количества растущих фолликулов, что убедительно свидетельствует о том, что изменение уровня АМГ в сыворотке крови, вызванное использованием ГК, является результатом изменения динамики роста фолликулов, а не прямого влияния на регуляцию гена АМГ. Однако нельзя исключать прямое влияние измененной гормональной среды на экспрессию АМГ. Несколько исследований показали, что индекс массы тела (ИМТ) отрицательно влияет на уровень АМГ. В работе Moslehi et al (28) было проанализировано 26 исследований. Пациенток разделили на три группы: на фертильную группу (не имеющих проблем с зачатием), с бесплодием без СПКЯ и с бесплодием с СПКЯ. Авторы обнаружили отрицательную корреляцию между ИМТ и АМГ во всех группах. Однако ИМТ не коррелировал с количеством растущих фолликулов, что позволяет предположить, что ИМТ может напрямую влиять на уровень АМГ, а не на функциональный овариальный резерв. Хотя точный механизм еще предстоит разгадать, считается, что лептин играет в этом определенную роль. Merhi и соавт. (29) продемонстрировали на культивируемых гранулезных клетках человека, выделенных из малых фолликулов (<14 мм), и из крупных фолликулов (≥14 мм), что лечение рекомбинантным лептином значительно уменьшало уровень АМГ. Все чаще признается, что витамин D влияет на уровень АМГ. Уровни витамина D изменяются в зависимости от сезона: летом они выше, чем зимой. Деннис и др. (47) показали, что АМГ у женщин репродуктивного возраста также демонстрируют сезонные колебания: зимой АМГ на 18% ниже, чем летом. В одном из исследований здоровые женщины были разделены на две группы: однократно принимающие витамин D, и принимающие плацебо (пустышку) (30). В течение 24 часов после лечения витамином D уровни АМГ в сыворотке резко возросли до 15,8 ± 1,1 нмоль/л по сравнению с 1,2 ± 0,7 нмоль/л у участников контрольной группы. Однако остается вопрос, увеличивает ли витамин D концентрацию АМГ в сыворотке напрямую за счет регуляции выработки АМГ или опосредованно за счет роста фолликулов. Чтобы ответить на этот вопрос, Сюй и др. (49) исследовали влияние лечения витамином D на развитие фолликулов и концентрацию АМГ у макак путем культивирования растущих фолликулов в присутствии витамина D. Анализ показал, что витамин D увеличивает выживаемость малых фолликулов, а уровни АМГ были значительно выше по сравнению с контролем (31). Эти данные позволяют предположить, что витамин D предотвращает гибель гранулезных клеток фолликула (окружающих яйцеклетку), а не напрямую регулирует выработку АМГ (32).
В современном мире возраст, когда женщина решает стать матерью, увеличился, а значит, и увеличился риск бесплодия у женщин после 35 лет (33). Учитывая выраженную связь между возрастным снижением числа «спящих» фолликулов, количеством растущих фолликулов и уровнем АМГ в крови, в нескольких исследованиях изучалось, может ли АМГ помочь в прогнозировании возраста наступления менопаузы. В недавнем исследовании, в котором большинство женщин имели избыточный вес или страдали ожирением, было показано, что женщины в возрасте от 45 до 49 лет с неопределяемым уровнем АМГ имели 60% вероятность наступления менопаузы в течение 5 лет (34). Авторы также отметили, что скорость снижения АМГ зависела от возраста, что ставит вопрос о том, в каком возрастном интервале и как часто следует измерять АМГ, чтобы точно предсказать возраст менопаузы. Ramezani Tehrani et al (35) продемонстрировали, что женщины со значением АМГ 0,1 нг/мл в возрасте 30 лет имеют прогнозируемый средний возраст наступления менопаузы 43,2 года.
АМГ помогает предсказать реакцию яичников на протоколы стимуляции. Низкие уровни АМГ коррелируют с плохим ответом.
Известно, что химиотерапия оказывает неблагоприятное воздействие на функцию яичников и увеличивает риск первичной недостаточности яичников (ПНЯ) после лечения. В ряде исследований были проанализированы уровни АМГ у пациенток с раком до и после лечения, в основном с раком молочной железы, который является самым распространенным онкологическим заболеванием у женщин во всем мире. После химиотерапии уровни АМГ снижаются до неопределяемого уровня (36,37). Такое быстрое снижение можно объяснить мгновенной гибелью растущих фолликулов, в которых вырабатывается АМГ. Последующее восстановление функции яичников у разных женщин происходит по-разному. Пациентки с раком молочной железы, у которых развилась ПНЯ, имели более низкие уровни АМГ до лечения, чем те, у которых менструации возобновились после лечения (38-40). У женщин с раком щитовидной железы лечение радиоактивным йодом также вызывает раннюю менопаузу. Уровни АМГ снижаются как минимум на 50% и лишь частично восстановливаются (41-43). Более того, влияние лечения радиоактивным йодом на уровень АМГ было более выраженным у пациенток в возрасте старше 35 лет (41,43). Таким образом, как и у пациенток с раком молочной железы, овариальный резерв может быть относительно защищен, если рак щитовидной железы диагностируется в более молодом возрасте.
Улучшенная чувствительность и автоматизация анализов АМГ усилили роль уровня АМГ как маркера функционального овариального резерва. Оценка уровней АМГ в сыворотке крови может быть полезной для прогнозирования реакции яичников на стимуляцию суперовуляции и возраста наступления менопаузы. Однако, нужно учитывать, что для правильной интерпретации уровня АМГ необходимы дополнительные знания о различных факторах, которые влияют на выработку АМГ. За последние годы количество тестов для измерения АМГ увеличилось. Однако существуют различия в технологии проведения анализа. Поэтому необходим международный стандарт, чтобы установить независимые от лабораторий пороговые значения АМГ и правильно его интерпритировать. Причин снижения АМГ и овариального резерва очень много. И одна из них — операции на яичниках. Подробнее на эту тему читайте в следующих публикациях.
Пишите в комментариях, все ли понятно и какие возникли вопросы?
Получить мою подробную консультацию по данному вопросу можно на очном приеме, записавшись по тел. кол-центра 8-800-700-70-01 или через приложение Мать и дитя со скидкой 5%.
Используемая литература:
- Loes M E Moolhuijsen, Jenny A Visser. Anti-Müllerian Hormone and Ovarian Reserve: Update on Assessing Ovarian Function. J Clin Endocrinol Metab. 2020 Nov; 105(11): 3361–3373.
- Dewailly D, Andersen CY, Balen A, et al. The physiology and clinical utility of anti-mullerian hormone in women. Hum Reprod Update. 2014;20(3):370-385.
- Gleicher N, Weghofer A, Barad DH. Defining ovarian reserve to better understand ovarian aging. Reprod Biol Endocrinol. 2011;9:23.
- Kevenaar ME, Meerasahib MF, Kramer P, et al. Serum anti-mullerian hormone levels reflect the size of the primordial follicle pool in mice. Endocrinology. 2006;147(7):3228-3234.
- Hansen KR, Hodnett GM, Knowlton N, Craig LB. Correlation of ovarian reserve tests with histologically determined primordial follicle number. Fertil Steril. 2011;95(1):170-175.
- von Wolff M, Roumet M, Stute P, Liebenthron J. Serum anti-mullerian hormone (AMH) concentration has limited prognostic value for density of primordial and primary follicles, questioning it as an accurate parameter for the ovarian reserve. Maturitas. 2020;134:34-40.
- Liebenthron J, Reinsberg J, van der Ven K, Saenger N, Kruessel JS, von Wolff M. Serum anti-müllerian hormone concentration and follicle density throughout reproductive life and in different diseases-implications in fertility preservation. Hum Reprod. 2019;34(12):2513-2522.
- Sermondade N, Sonigo C, Sifer C, et al. Serum antimüllerian hormone is associated with the number of oocytes matured in vitro and with primordial follicle density in candidates for fertility preservation. Fertil Steril. 2019;111(2):357-362.
- Kelsey TW, Wright P, Nelson SM, Anderson RA, Wallace WH. A validated model of serum anti-müllerian hormone from conception to menopause. PLoS One. 2011;6(7):e22024.
- Lie Fong S, Visser JA, Welt CK, et al. Serum anti-müllerian hormone levels in healthy females: a nomogram ranging from infancy to adulthood. J Clin Endocrinol Metab. 2012;97(12):4650-4655.
- Wallace WH, Kelsey TW. Human ovarian reserve from conception to the menopause. PLoS One. 2010;5(1):e8772.
- Du X, Ding T, Zhang H, et al. Age-specific normal reference range for serum anti-müllerian hormone in healthy Chinese Han women: a nationwide population-based study. Reprod Sci. 2016;23(8):1019-1027.
- Nelson SM, Messow MC, McConnachie A, et al. External validation of nomogram for the decline in serum anti-müllerian hormone in women: a population study of 15 834 infertility patients. Reprod Biomed Online. 2011;23(2):204-206.
- Nelson SM, Messow MC, Wallace AM, Fleming R, McConnachie A. Nomogram for the decline in serum antimullerian hormone: a population study of 9601 infertility patients. Fertil Steril. 2011;95:736-741.
- Bozdag G, Calis P, Zengin D, Tanacan A, Karahan S. Age related normogram for antral follicle count in general population and comparison with previous studies. Eur J Obstet Gynecol Reprod Biol. 2016;206:120-124.
- Loy SL, Cheung YB, Fortier MV, et al. Age-related nomograms for antral follicle count and anti-mullerian hormone for subfertile Chinese women in Singapore. PLoS One. 2017;12(12):e0189830.
- Nelson SM, Aijun S, Ling Q, et al. Ethnic discordance in serum anti-müllerian hormone in healthy women: a population study from China and Europe. Reprod Biomed Online. 2020;40(3):461-467.
- Bleil ME, Gregorich SE, Adler NE, Sternfeld B, Rosen MP, Cedars MI. Race/ethnic disparities in reproductive age: an examination of ovarian reserve estimates across four race/ethnic groups of healthy, regularly cycling women. Fertil Steril. 2014;101(1):199-207.
- Schuh-Huerta SM, Johnson NA, Rosen MP, Sternfeld B, Cedars MI, Reijo Pera RA. Genetic variants and environmental factors associated with hormonal markers of ovarian reserve in Caucasian and African American women. Hum Reprod. 2012;27(2):594-608.
- Tsepelidis S, Devreker F, Demeestere I, Flahaut A, Gervy Ch, Englert Y. Stable serum levels of anti-müllerian hormone during the menstrual cycle: a prospective study in normo-ovulatory women. Hum Reprod. 2007;22(7):1837-1840.
- Gorkem U, Togrul C. Is there a need to alter the timing of anti-müllerian hormone measurement during the menstrual cycle? Geburtshilfe Frauenheilkd. 2019;79(7):731-737.
- Lambert-Messerlian G, Plante B, Eklund EE, Raker C, Moore RG. Levels of antimullerian hormone in serum during the normal menstrual cycle. Fertil Steril. 2016;105:208-213 e201.
- Melado L, Lawrenz B, Sibal J, et al. Anti-müllerian hormone during natural cycle presents significant intra and intercycle variations when measured with fully automated assay. Front Endocrinol (Lausanne). 2018;9:686.
- Overbeek A, Broekmans FJ, Hehenkamp WJ, et al. Intra-cycle fluctuations of anti-müllerian hormone in normal women with a regular cycle: a re-analysis. Reprod Biomed Online. 2012;24(6):664-669.
- Bungum L, Tagevi J, Jokubkiene L, et al. The impact of the biological variability or assay performance on AMH measurements: a prospective cohort study with AMH tested on three analytical assay-platforms. Front Endocrinol (Lausanne). 2018;9:603.
- Amer SAKS, James C, Al-Hussaini TK, Mohamed AA. Assessment of circulating anti-müllerian hormone in women using hormonal contraception: a systematic review. J Womens Health (Larchmt). 2020;29(1):100-110.
- Landersoe SK, Forman JL, Birch Petersen K, et al. Ovarian reserve markers in women using various hormonal contraceptives. Eur J Contracept Reprod Health Care. 2020;25(1):65-71.
- Moslehi N, Shab-Bidar S, Ramezani Tehrani F, Mirmiran P, Azizi F. Is ovarian reserve associated with body mass index and obesity in reproductive aged women? A meta-analysis. Menopause. 2018;25(9):1046-1055.
- Merhi Z, Buyuk E, Berger DS, et al. Leptin suppresses anti-mullerian hormone gene expression through the JAK2/STAT3 pathway in luteinized granulosa cells of women undergoing IVF. Hum Reprod. 2013;28(6):1661-1669.
- Dennis NA, Houghton LA, Jones GT, van Rij AM, Morgan K, McLennan IS. The level of serum anti-müllerian hormone correlates with vitamin D status in men and women but not in boys. J Clin Endocrinol Metab. 2012;97(7):2450-2455.
- Dennis NA, Houghton LA, Pankhurst MW, Harper MJ, McLennan IS. Acute supplementation with high dose vitamin D3 increases serum anti-mullerian hormone in young women. Nutrients. 2017;9(7):719.
- Xu J, Hennebold JD, Seifer DB. Direct vitamin D3 actions on rhesus macaque follicles in three-dimensional culture: assessment of follicle survival, growth, steroid, and antimullerian hormone production. Fertil Steril. 2016;106:1815-1820 e1811.
- Merhi Z, Doswell A, Krebs K, Cipolla M. Vitamin D alters genes involved in follicular development and steroidogenesis in human cumulus granulosa cells. J Clin Endocrinol Metab. 2014;99(6):E1137-E1145.
- Balasch J, Gratacós E. Delayed childbearing: effects on fertility and the outcome of pregnancy. Fetal Diagn Ther. 2011;29(4):263-273.
- Kim C, Slaughter JC, Wang ET, et al. Anti-müllerian hormone, follicle stimulating hormone, antral follicle count, and risk of menopause within 5 years. Maturitas. 2017;102:18-25.
- Ramezani Tehrani F, Bidhendi Yarandi R, Solaymani-Dodaran M, Tohidi M, Firouzi F, Azizi F. Improving prediction of age at menopause using multiple anti-mullerian hormone measurements: the Tehran lipid-glucose study. J Clin Endocrinol Metab. 2020;105:1589-1598.
- Zhong Y, Lin Y, Cheng X, et al. GnRHa for ovarian protection and the association between AMH and ovarian function during adjuvant chemotherapy for breast cancer. J Cancer. 2019;10(18):4278-4285.
- Anderson RA, Mansi J, Coleman RE, Adamson DJA, Leonard RCF. The utility of anti-müllerian hormone in the diagnosis and prediction of loss of ovarian function following chemotherapy for early breast cancer. Eur J Cancer. 2017;87:58-64.
- Xue C, Wei W, Sun P, et al. Pretreatment anti-mullerian hormone-based nomogram predicts menstruation status after chemotherapy for premenopausal women with hormone receptor-positive early breast cancer. Breast Cancer Res Treat. 2019;173(3):619-628.
- Passildas J, Collard O, Savoye AM, et al. Impact of chemotherapy-induced menopause in women of childbearing age with non-metastatic breast cancer - preliminary results from the MENOCOR study. Clin Breast Cancer. 2019;19(1):e74-e84.
- Yaish I, Azem F, Gutfeld O, et al. A single radioactive iodine treatment has a deleterious effect on ovarian reserve in women with thyroid cancer: results of a prospective pilot study. Thyroid. 2018;28(4):522-527.
- Evranos B, Faki S, Polat SB, Bestepe N, Ersoy R, Cakir B. Effects of radioactive iodine therapy on ovarian reserve: a prospective pilot study. Thyroid. 2018;28(12):1702-1707.
- van Velsen EFS, Visser WE, van den Berg SAA, et al. Longitudinal analysis of the effect of radioiodine therapy on ovarian reserve in females with differentiated thyroid cancer. Thyroid. 2020;30(4):580-587.